一��、酸����、堿����、鹽的組成
酸是由氫元素和酸根組成的化合物 如:硫酸(H2SO4)、鹽酸(HCl)����、硝酸(HNO3)堿是由金屬元素和氫氧根組成的化合物 如:氫氧化鈉、氫氧化鈣����、氨水(NH3·H2O)鹽是由金屬元素元素(或銨根)和酸根組成的化合物 如:氯化鈉、碳酸鈉酸�����、堿、鹽的水溶液可以導(dǎo)電(原因:溶于水時(shí)離解形成自由移動(dòng)的陰��、陽(yáng)離子)
二����、酸
1、濃鹽酸��、濃硫酸的物理性質(zhì)����、特性、用途
|
|
|
|
|
|
“純凈”:無(wú)色液體工業(yè)用鹽酸:黃色(含F(xiàn)e3+) |
|
|
|
|
|
|
|
揮發(fā)性(敞口置于空氣中����,瓶口有白霧) |
|
|
|
|
①金屬除銹②濃硫酸作干燥劑③生產(chǎn)化肥����、精煉石油 |
2��、酸的通性(具有通性的原因:酸離解時(shí)所生成的陽(yáng)離子全部是H+)
(1)與酸堿指示劑的反應(yīng):使紫色石蕊試液變紅色��,不能使無(wú)色酚酞試液變色(2)金屬 + 酸 → 鹽 + 氫氣(3)堿性氧化物 + 酸 → 鹽 + 水(4)堿 + 酸 → 鹽 + 水(5)鹽 + 酸 → 另一種鹽 + 另一種酸(產(chǎn)物符合復(fù)分解條件)
3����、三種離子的檢驗(yàn)
|
|
|
|
|
|
|
|
①Ba(NO3)2及HNO3②HCl 及BaCl2 |
|
|
|
三��、堿
1��、氫氧化鈉��、氫氧化鈣的物理性質(zhì)����、用途
|
|
|
|
|
|
|
|
|
|
燒堿����、火堿��、苛性鈉(具有強(qiáng)腐蝕性) |
|
|
|
Ca(OH)2+Na2CO3== CaCO3↓+2NaOH |
|
|
|
①氫氧化鈉固體作干燥劑②化工原料:制肥皂����、造紙③去除油污:爐具清潔劑中含氫氧化鈉 |
①工業(yè):制漂白粉②農(nóng)業(yè):改良酸性土壤、配波爾多液③建筑: |
2��、堿的通性(具有通性的原因:離解時(shí)所生成的陰離子全部是OH-)
(1)堿溶液與酸堿指示劑的反應(yīng):使紫色石蕊試液變藍(lán)色����,使無(wú)色酚酞試液變紅色(2)酸性氧化物+堿 → 鹽+水(3)酸+堿 → 鹽+水(4)鹽+堿 → 另一種鹽+另一種堿(反應(yīng)物均可溶,產(chǎn)物符合復(fù)分解條件)注:①難溶性堿受熱易分解(不屬于堿的通性)如Cu(OH)2 ΔCuO +H2O2Fe(OH)3 ΔFe2O3+3H2O②常見(jiàn)沉淀:AgCl↓ BaSO4↓ Cu(OH)2↓ F e(OH)3↓ Mg(OH)2↓ BaCO3↓ CaCO3↓③復(fù)分解反應(yīng)的條件:當(dāng)兩種化合物互相交換成分�����,生成物中有沉淀或有氣體或有水生成時(shí)�����,復(fù)分解反應(yīng)才可以發(fā)生�����。
四、酸性氧化物與堿性氧化物
|
|
|
|
|
|
凡能與堿反應(yīng)生成鹽和水的氧化物大多數(shù)非金屬氧化物是酸性氧化物大多數(shù)酸性氧化物是非金屬氧化物 |
凡能與酸反應(yīng)生成鹽和水的氧化物大多數(shù)金屬氧化物是堿性氧化物所有堿性氧化物是金屬氧化物 |
|
|
(1)大多數(shù)可與水反應(yīng)生成酸CO2+H2O== H2CO3SO2+H2O== H2SO3SO3+H2O== H2SO4 |
(1)少數(shù)可與水反應(yīng)生成堿Na2O +H2O== 2NaOHK2O +H2O== 2KOHBaO +H2O== Ba(OH)2CaO +H2O== Ca(OH)2 |
|
(2) 酸性氧化物+堿 → 鹽+水CO2 +Ca(OH)2== CaCO3↓+H2O(不是復(fù)分解反應(yīng)) |
(2) 堿性氧化物+酸 → 鹽+水Fe2O3+6HCl== 2FeCl3+3H2O |
|
五��、中和反應(yīng) 溶液酸堿度的表示法--pH
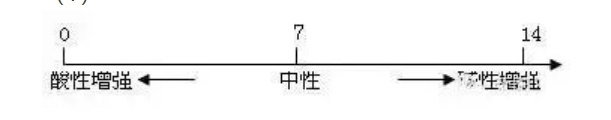
1��、定義:酸與堿作用生成鹽和水的反應(yīng)2��、應(yīng)用:(1)改變土壤的酸堿性(2)處理工廠的廢水(3)用于醫(yī)藥3��、溶液酸堿度的表示法--pH(1)
(2)pH的測(cè)定:最簡(jiǎn)單的方法是使用pH試紙用玻璃棒(或滴管)蘸取待測(cè)試液少許����,滴在pH試紙上��,顯色后與標(biāo)準(zhǔn)比色卡對(duì)照��,讀出溶液的pH(讀數(shù)為整數(shù))(3)酸雨:正常雨水的pH約為5.6(因?yàn)槿苡蠧O2)pH<5.6的雨水為酸雨
編輯推薦:
2024年中考各科目重點(diǎn)知識(shí)匯總
最新中考資訊��、中考政策��、考前準(zhǔn)備��、中考預(yù)測(cè)�����、錄取分?jǐn)?shù)線等
中考時(shí)間線的全部重要節(jié)點(diǎn)
盡在"中考網(wǎng)"微信公眾號(hào)

歡迎使用手機(jī)、平板等移動(dòng)設(shè)備訪問(wèn)中考網(wǎng)��,2024中考一路陪伴同行�����!>>點(diǎn)擊查看











